Systembiologie klärt nach 40 Jahren den Mechanismus der Wundheilung auf
Von Kai Safferling, Thomas Sütterlin und Niels Grabe
Die Haut, das größte Organ des Menschen, umgibt uns wie ein Schutzschild. Sie schützt uns vor schädlichen Umwelt-Einflüssen, gefährlichen Mikroorganismen und verhindert den Verlust von lebenswichtigem Wasser. Ohne die vielfältigen Funktionen und Mechanismen der Haut wären wir unserer Umgebung schutzlos ausgeliefert. Die meiste Zeit jedoch merken wir von all diesen Mechanismen, die in unserer Haut ablaufen, nichts. Dies ändert sich jedoch schmerzlich, wenn wir uns eine Verletzung zuziehen und damit die Barrierefunktion der Haut schädigen. Im Rahmen des vom Bundesministerium für Bildung und Forschung geförderten Projektes MedSys-Chronic Wounds hat eine Forschergruppe am Tissue Imaging and Analysis Center (TIGA) in Heidelberg die Wundheilung systembiologisch untersucht und grundlegende Wundschlussmechanismen entschlüsselt.
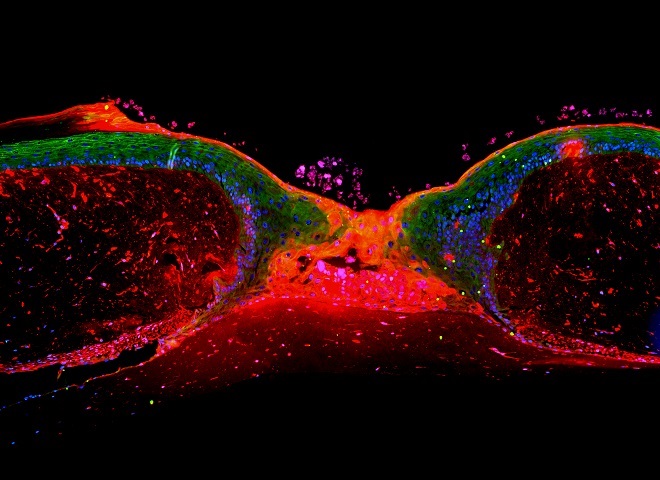
Die menschliche Haut besteht aus mehreren Zellschichten, die von einem steten Strom aus sich neu bildenden Zellen genährt werden. Die einzelnen Hautzellen, die Keratinozyten, wandern hierbei ausgehend von der Basalschicht zur Hautoberfläche. Während dieser Wanderung ändern die Zellen ihre Struktur und verhärten, sodass sie in der obersten Hautschicht einen essentiellen Schutz darstellen. Bei einer Verletzung wird diese Schutzschicht durchbrochen. Um die Wunde zu schließen und die Integrität des Organismus wiederherzustellen, greifen zelluläre Prozesse wie Proliferation, Migration und Differenzierung eng ineinander.
Hierbei lässt sich der Wundheilungsprozess in vier verschiedene Phasen einteilen: In Phase 1 bildet das frisch aus der Wunde austretende Blut bei Kontakt mit der Luft Wundschorf, der einerseits den Verlust weiterer Körperflüssigkeiten verhindert, andererseits als Reservoir für Blutplättchen, die Thrombozyten, dient. Die Thrombozyten locken durch Absonderung von Botenstoffen (PDGF) Immunzellen an. Diese beseitigen in Phase 2, der Inflammatorischen Phase, gefährliche Mikroorganismen, die in die Wunde eingedrungen sind. Darüber hinaus sondern sie Wachstumsfaktoren ab, welche zu einem Zellteilungsimpuls des umliegenden Gewebes sowie zu einer Mobilisierung der Keratinozyten führen. In Phase 3, der Reepithelialisierungsphase, wandern diese aktivierten Zellen unterhalb des Wundschorfes in die Wunde ein und versuchen, den Gewebedefekt zu schließen. Hierbei bilden die einwandernden Zellen eine trianguläre Struktur, die Migrationszunge aus, welche sich ausgehend vom Wundrand immer weiter verjüngt und an ihrer Spitze aus einer einzelnen Zellschicht besteht. In der letzten Wundheilungsphase, der Remodellierungsphase, wird das die Wunde umgebende Bindegewebe umgebaut. Nach dieser Phase ist die Wundheilung abgeschlossen und eine zurückbleibende Narbe erinnert an die Verletzung.
Wie schließt sich die Wunde genau?
Trotz der Einteilung der Wundheilung in die verschiedenen Phasen sind bislang viele der zellulären Reaktionen und Interaktionen innerhalb dieses komplexen Mechanismus ungeklärt. Eine zentrale, seit 40 Jahren unbeantwortete Frage lautet, wie sich die Keratinozyten in der Reepithelialisierungsphase innerhalb der Migrationszunge organisieren, um die Wunde zu schließen. In der Literatur gab es bislang zwei grundlegende Erklärungsmodelle, um den Reepithelialisierungsmechanismus zu beschreiben: 1) Das „Tractor-Tread“-Modell besagt, dass sich das Epithel in einem Block in die Wunde schiebt, um diese zu schließen und impliziert unveränderte starre Positionen der Keratinozyten innerhalb der Migrationszunge. 2) Das „Leap-Frog“-Modell hingegen postuliert eine Migration suprabasaler Keratinozyten, d. h. der oberen Hautschicht, welche über die basalen Zellen der unteren Hautschicht wandert, um die Wunde zu schließen.
Um die Frage zu klären, ob eines dieser beiden grundlegenden Modelle korrekt ist, wurde am TIGA Center im Rahmen des BMBF-Förderprojektes MedSys–Chronic Wounds der Migrationsmechanismus des Epithels systembiologisch untersucht. Hierbei wurde der gesamte Regenerationsprozess der Haut systematisch in die zellulären Prozesse der Proliferation, Migration und Differenzierung zerlegt, welche einzeln quantitativ vermessen wurden. Auf Grundlage dieser Daten wurde ein neuartiges systembiologisches, multizelluläres Erklärungsmodell des Wundheilungsmechanismus erstellt (Safferling et al., 2013). Dieses Modell zeigt zunächst, dass die bisherigen Theorien des Wundschlusses falsch sind. Stattdessen wurde mit dem Extending Shield-Mechanismus (ESM) eine neue 3D-Zellbewegungsform entdeckt und gleichzeitig die entscheidende Rolle der die Wunde umgebenden intakten Haut aufgezeigt.
Tiefe Einblicke in den komplexen Prozess der Wundheilung
Um die zellulären Mechanismen während der Wundheilung zu quantifizieren, wurde am TIGA Center ein in vitro Wundheilungsmodell entwickelt. Dieses Modell basiert auf humaner Haut, welche in vitro die gleiche zelluläre Schichtung aufweist wie normale menschliche Haut. In dieses Modell wurde eine kreisrunde Wunde gesetzt und die Teilung der epithelialen Zellen anhand des Proliferationsmarkers Ki-67 quantifiziert. Die Daten zeigen, dass das Modell nach einer Verwundung mit einem initialen Proliferationsimpuls antwortet, welcher die Basalzellen des gesamten Modells aktiviert. Während sich im Laufe der Zeit die Zellteilungsaktivität in den wundfernen Regionen des Modells abschwächt, bleibt sie innerhalb der Wunde auf einem konstant hohen Level. Durch dieses Proliferationsverhalten erzeugt das die Wunde umgebende Gewebe ausreichend neue Zellen, welche sich durch Einwandern in das Wundareal am Wundschluss beteiligen.
Obwohl die Proliferationsdaten Aufschluss über die systemische Gewebereaktion nach Verwundung liefern, blieben nach dieser initialen Untersuchung viele weitere Fragen bezüglich des Wundheilungsmechanismus unbeantwortet: Wie organisieren sich die Zellen innerhalb der Migrationszunge? Bleiben die Zellen während der Migration miteinander in Kontakt oder wandern sie in loser Formation in die Wunde ein? Sind alle Zellen gleich oder übernehmen sie während des Wundschlusses unterschiedliche Aufgaben?