In jedem Tumor stecken Informationen, die für die Wahl der richtigen Therapie entscheidend sind. Bisher ist es jedoch schwierig, an sie heranzukommen. Ein neues KI-Tool soll das Problem lösen und der Krebsforschung damit zehn Jahre Zeit sparen.
von Melanie Bergs und Gesa Terstiege
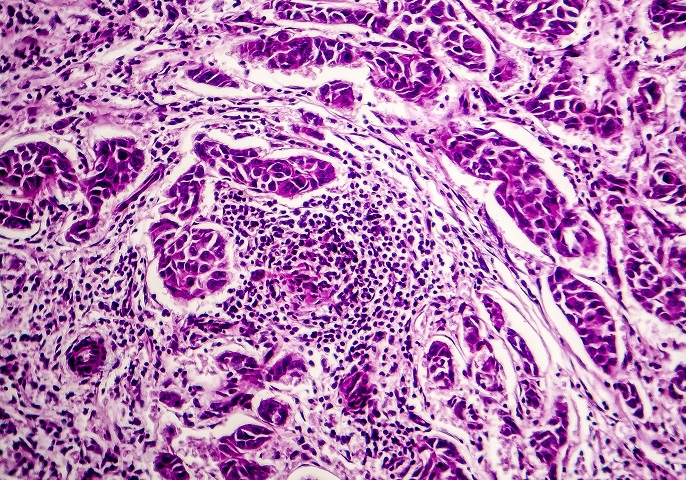
„Tumor-Matsche“, so nennen die Forscherinnen und Forscher das Material, das ihnen so wichtige Informationen liefert. „Matsche“ ist in diesem Sinne nicht negativ gemeint, sondern steht bildlich dafür, dass diese Informationen in einer bislang schwer überschaubaren Masse vermengt sind. Der Bioinformatiker Professor Dr. Rainer Spang von der Universität Regensburg und sein Forschungsteam haben das Ziel, diese Informationen mithilfe von Künstlicher Intelligenz zu sortieren und auszuwerten. Wenn ihnen dies gelingt, würde das für die Krebsforschung einen enormen Zeitgewinn bedeuten. Das Bundesministerium für Bildung und Forschung unterstützt sie dabei im Rahmen der Fördermaßnahme „CompLS – Computational Life Sciences“.
Seit 20 Jahren messen Krebsforscherinnen und -forscher, welche Gene im jeweiligen Tumor in welcher Intensität aktiv sind. Dies hilft dabei, die richtige Therapieentscheidung zu treffen. Da jeder Tumor einzigartig ist, spricht er auch nur auf bestimmte Medikamente an. Um an die Moleküle der Zellen im Tumor zu gelangen, müssen diese aufgebrochen werden. Dadurch entsteht ein Molekül-Gemisch, das die Regensburger Forscher „Tumor-Matsche“ genannt haben. „Da die Tumore jedoch nicht nur aus Tumorzellen bestehen, werden diese beim Aufschließen mit Teilen von Bindegewebs- und Immunzellen vermischt“, erklärt Spang. „Das macht es schwierig, die gewonnenen molekularen Informationen den richtigen Zellen zuzuordnen.“
KI-Tool soll Therapie-Vorhersagen deutlich verbessern
Wenn ein Gewebe etwa die Information enthält, dass Gene für Zellteilung hochreguliert sind, stellt sich die Frage, woher dieses Signal kommt. Stammt es aus den Tumorzellen, so wächst der Tumor. Kommt das Signal aber aus den Immunzellen, so bekämpft das Immunsystem den Tumor. Für die behandelnden Ärztinnen und Ärzte ist dies ein gewaltiger Unterschied: Je nach Szenario müssten sie völlig andere Therapiewege gehen. Hier setzt das Forschungsteam um Spang an. Die Wissenschaftlerinnen und Wissenschaftler entwickeln ein KI-Tool, das die Messdaten den jeweiligen Zellen zuordnet und damit die Therapie-Vorhersagen deutlich verbessern könnte.
Seit kurzer Zeit gibt es zwar auch Verfahren, die Messungen für einzelne Tumorzellen möglich machen. Hier fehlen jedoch die Erfahrungswerte. „Von den so untersuchten Fällen weiß man noch nicht, wie sich die Krankheiten entwickeln werden“, sagt Spang. Das bedeutet, aus einzelnen Messdaten kann noch keine Therapieempfehlung abgeleitet werden. Zur Analyse der „Tumor-Matsche“ werden dagegen seit Jahrzehnten Vergleichswerte gesammelt, die Rückschlüsse für bestimmte Patientengruppen zulassen. „Man braucht Tausende von Patientinnen und Patienten, um verlässliche Zahlen zu bekommen“, erklärt Spang. „Und man muss abwarten, wie sich die Krankheit im Laufe der Zeit entwickelt.“ Bis die Einzelzell-Datensätze so weit sind, werden noch bis zu 15 Jahre vergehen, schätzt Spang.
„Mindestens zehn Jahre Zeit gewinnen“
Deshalb wollen die Regensburger Bioinformatiker es mit ihrem Tool schaffen, Informationen zu einzelnen Zellen aus den Messdaten der „Tumor-Matsche“ zu erhalten. Denn die entscheidenden Signale sind auch im unsortierten Gewebe enthalten, sie sind lediglich überdeckt. Sie aus dem molekularen Chaos herauszufiltern, ist die Aufgabe der KI. „Wenn wir das schaffen, dann können wir zum Wohle der Patientinnen und Patienten mindestens zehn Jahre Zeit gewinnen, bis die neuen Methoden soweit sind.“
Die neuen aufgeschlüsselten Daten der Regensburger Forscherinnen und Forscher könnten darüber hinaus Anknüpfungspunkte für neue Therapien und Medikamente liefern. Als Beispiel nennt Spang die personalisierten Immuntherapien, die im Kampf gegen Krebs immer häufiger zum Einsatz kommen. In der Praxis könnte das so aussehen: Das KI-Tool hat festgestellt, dass bestimmte Immunzellen den Tumor zwar erkannt haben, aber nicht angreifen. Ursache hierfür ist eine Blockade. Die Ärztin oder der Arzt könnte dann eine Immuntherapie verordnen. Diese würde die Blockade auflösen und die Immunabwehr erfolgreich in Gang setzen.