Basale Zellen als Key Driver der Wundheilung
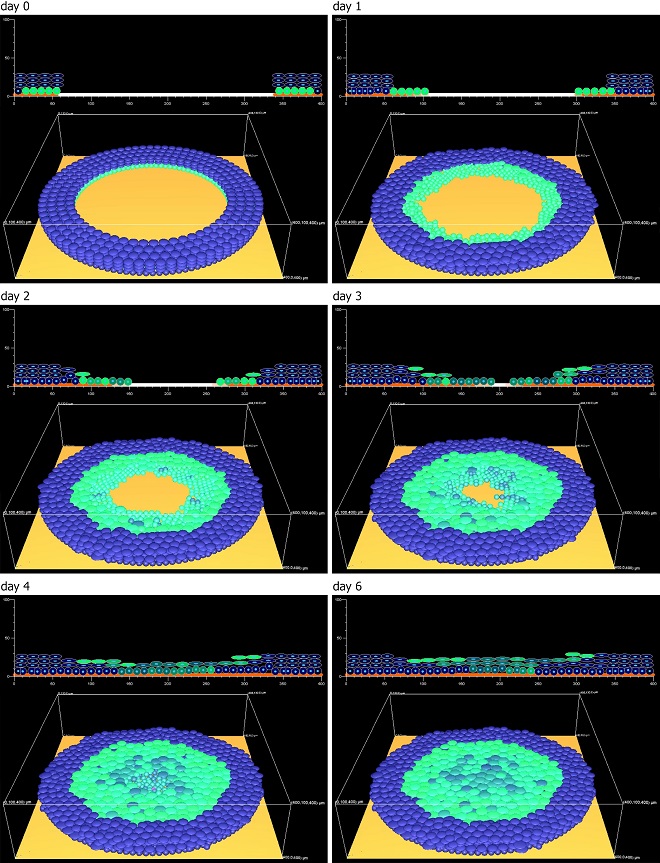
Um diese mechanistischen Fragen aufzuklären, wurde eine neuartige Fluoreszenz-Doppelfärbung entwickelt, deren Prinzip aus der sequentiellen Applikation eines grünen und eines roten Farbstoffes in die Wunde besteht: Direkt nach Verwundung wird ein grüner Farbstoff (CMFDA), welcher sich in die Zellmembranen der Keratinozyten einlagert, in die Wunde appliziert. Dieser grüne Farbstoff markiert die Hautzellen, welche die Wunde unmittelbar umranden. Durch die Verwundung beginnen die grün markierten Zellen in die Wunde einzuwandern. Am zweiten Tag nach Verwundung erfolgt die Applikation des roten Farbstoffs (CMTPX). Dieser färbt neben den bereits grün markierten „alten“ Zellen des Wundrandes auch zusätzlich die „Neuankömmlinge“, welche aus wundfernen Bereichen in die Wunde eingewandert sind. Diese Färbemuster erlauben die Analyse räumlicher Zellverteilungen innerhalb der Migrationszunge.
Die Analyse der Färbemuster ergab eine Akkumulation beider Farbstoffe in den oberen Zellschichten, während basale Zellen am Rand sowie der Mitte der sich ausbildenden Zellzunge keinerlei Färbung aufwiesen. Folglich müssen diese basalen Zellen aus dem unverwundeten Gewebe, welches von keiner der beiden Zellfärbungen erfasst wurde, in das Wundareal eingewandert sein. Die Tatsache, dass basale Zellen aktiv in die Wunde migrieren, während die suprabasalen Keratinozyten stationär im oberen Teil der Zellzunge verbleiben, widerlegt die beiden bisher postulierten Migrationsmodelle.
Doch warum existieren innerhalb der Migrationszunge zwei unterschiedliche Zellverhalten? Aufschluss lieferte die Analyse der zellulären Kontakte, bei der sich eine Einteilung der Migrationszunge in zwei distinkte Kompartimente ergab: Während das obere Kompartiment durch die Ausbildung starrer, starker Zellverbindungen gekennzeichnet war, zeichnete sich das untere Kompartiment durch sehr flexible, leicht abzubauende Zell-Zell-Proteine aus. Durch diese starren Verbindungen bietet das obere Kompartiment mechanische Stabilität und schirmt die darunterliegenden Zellen wie ein Schutzschild ab. Die basalen Zellen des unteren Kompartiments sind durch ihre flexiblen Zellkontakte äußerst mobil und wandern unter diesem Schutzschild in das Wundareal ein, um die Wunde zu schließen.
Wundheilung in silico: Modellierung des Migrationsmechanismus
Die Kombination der Ergebnisse lieferte ein neuartiges Modell zur Erklärung des Wundheilungsprozesses: den Extending Shield-Mechanismus. Hierbei muss man sich die Migrati-onszunge als dynamische Struktur vorstellen, die ständig in Bewegung ist. Während Zellen an der vordersten Front dieser Migrationszunge in den Wundbereich einwandern, um für ihre Nachfolger durch Umstrukturierung der Wunde den Weg zu ebnen, drängen von hinten, aus unverwundeten Bereichen Basalzellen nach. Diese nachrückenden Basalzellen schieben sich durch gezielte Steuerung von Zell-Zell-Verbindungen am sogenannten Liftingpoint übereinander und bilden ein mehr-schichtiges Epithel. Bei Betrachtung der triangulären Struktur der Migrationszunge markiert der Lifting-point folgerichtig den Punkt, an dem die Einzelzellschicht in ein mehrschichtiges Epithel übergeht. Der Name des Extending Shield-Mechanismus leitet sich durch die Basalzellen ab, welche unter dem Schutzschild des oberen Kompartimentes einwandern und dieses selbst durch Übertritt in das obere Kompartiment am Lifting-point sukzessive verlängern.
Der entwickelte Extending Shield-Mechanismus beruht auf histologischen Daten. Hierbei handelt es sich um Momentaufnahmen der Wundheilung, die Aussagen über mögliche zelluläre Vertei-lungsmuster innerhalb der Migrationszunge zulassen, jedoch keinerlei dynamische Daten liefern. Um einen direkten Einblick in das dynamische zelluläre Migrationsverhalten während der Wundheilung zu bekommen, wurde das in vitro-Modell in silico nachgebildet. Als Grundlage hierfür dienten die experimentell erhobenen Daten bezüglich zellulärer Kontakte, Proliferation, Differenzierung sowie Migration, welche in die ebenfalls am TIGA Center entwickelte multizelluläre Modellierungsplatt-form EPISIM integriert wurden (Sütterlin et al., 2009; Sütterlin et al., 2013).
Vielfältige medizinische Eingriffsmöglichkeiten
Das finale in silico-Modell enthielt auf Basis dieser Ergebnisse vier spezifische Zellpopulationen mit distinkten Eigenschaften (siehe Abbildung). Jede Zelle dieser Populationen beeinflusst sich und die sie umgebenden Zellen durch Auswirkung von Adhäsions- und interzellulären Druckkräften. Dadurch entstehen dynamische zelluläre Verhaltensmuster, die Aussagen über den biologischen Migrationsmechanismus zulassen. So wanderten in silico die Basalzellen unter den schützenden Suprabasalzellen hindurch und wurden an einem bestimmten Punkt von nachrü-ckenden Basalzellen in das suprabasale Kompartiment angehoben, um den Schutzschild zu verlängern. Damit ermöglicht die in silico-Modellierung dynamische Einblicke, die durch rein experimentelle Methoden nicht möglich gewesen wären und lieferten das letzte Puzzleteil für den Extending Shield-Mechanismus.
Durch das Verständnis des epithelialen Migrationsmechanismus während der Wundheilung lassen sich vielfältige medizinische Eingriffsmöglichkeiten ableiten. So lassen sich beispielsweise durch Integration von Wachstumsfaktoren in Pflaster und Wundauflagen die Reaktionen des umliegenden Gewebes steuern und beschleunigen. Dies führt zu einem schnelleren Wundschluss und einem reduzierten Risiko für Infektionen und chronische Wunden.
Steckbrief Forschungsprojekt:
Projektname:
MedSys-Chronic Wounds (BMBF-Verbund)
Beteiligte Partner:
Prof. Dr. Peter Angel, DKFZ Heidelberg (Koordinator)
Prof. Dr. Petra Boukamp, DKFZ Heidelberg
Prof. Dr. Peter Schirmacher / Dr. Kai Breuhahn, Institut für Pathologie, Universitätsklinik Heidelberg
Prof. Dr. Günter Germann, Ethianum, Universitätsklinik Heidelberg
Prof. Dr. Roland Eils, DKFZ Heidelberg
Dr. Jürgen Eils / Dr. Chris Lawerenz, DKFZ Heidelberg
Dr. Hauke Busch, Institut für Molekulare Medizin und Zellforschung, Zentrum für Biochemie und Molekulare Zellforschung, Freiburg
Referenzen:
Safferling et al. (2013). Wound healing revised: A novel reepithe-lialization mechanism revealed by in vitro and in silico models. Journal of Cell Biology 203(4), 691-709.
Sütterlin et al. (2013). Bridging the scales: semantic integration of quantitative SBML in graphical multi-cellular models and simulations with EPISIM and COPASI. Bioinformatics, 29(2), 223–229.
Sütterlin et al. (2009). Modeling multi-cellular behavior in epi-dermal tissue homeostasis via finite state machines in multi-agent systems. Bioinformatics, 25(16), 2057–2063.